©Creative Commons, Prof. Dr. Martin Empfing, HIPS
RSV-Infektionen verhindern: Neue Wirkstoffe blockieren den Eintritt der Viren in die Zellen
Um Abhilfe gegen die weit verbreitete Infektionskrankheit RSV zu schaffen, tauchen Forschende tief in die Details der Virusoberfläche ein. Ihr Ziel: Schon die erste Annäherung des Erregers effektiv zu blockieren.
Das weltweit verbreitete Respiratorische Synzytial-Virus (RSV) verursacht Atemwegsinfektionen, die insbesondere für Säuglinge und ältere Menschen gefährlich werden können. Etwa 33 Millionen Kinder unter fünf Jahren erkranken jedes Jahr schwer an einer RSV-Infektion, über 100 000 von ihnen sterben.
Dabei behandelt man bisher die Symptome ...
Bisher keine erfolgreiche Therapie
Seit 2023 sind Impfstoffe für ältere Menschen und Schwangere zugelassen, letzterer schützt das Neugeborene der Geimpften; zudem gibt es eine Passivimpfung für Kleinkinder. Aber nicht alle gefährdeten Menschen nehmen die Impfung in Anspruch; und natürlich verleiht sie keinen hundertprozentigen Schutz. "Es wird immer schwere Erkrankungen geben, die eine Behandlung notwendig machen", sagt Thomas Pietschmann. "Dabei behandelt man bisher die Symptome, es gibt keine direkt antivirale Therapie." Der Professor für Experimentelle Virologie an der Medizinischen Hochschule Hannover und Direktor des Instituts für Experimentelle Virologie am Twincore hat sich vorgenommen, das zu ändern. Dafür hat er das Projekt OPTIS ins Leben gerufen. Die VolkswagenStiftung fördert es seit 2022.
Ohne Fusion keine Infektion.
Viren verschmelzen mit Zellen
Mit Forschenden aus Deutschland und Frankreich möchte Pietschmann Moleküle entwickeln, die schon den Auftakt der Infektion effektiv blockieren. Gelangt ein RS-Virus in die Atemwege, verschmilzt seine Hülle mit der einer Körperzelle, ähnlich wie zwei aufeinandertreffende Seifenblasen. "Diese Fusion ist der erste entscheidende Schritt, damit Virus in die Zelle gelangen kann", erklärt der Virologe. "Ohne Fusion keine Infektion."
Essenziell für die Verschmelzung ist ein bestimmtes Bauteil der Virushülle, das F-Protein. "Man kann es sich vorstellen wie eine gespannte Mausefalle", beschreibt Pietschmann. "Bei Kontakt mit der Zelloberfläche schnappt es zu – die Fusion von Zelle und Virus findet statt."
Dieses Zuschnappen des F-Proteins wollen die Wisschaftler:innen blockieren und so verhindern, dass das Virus in die Zelle eintritt. Die Wirkstoffe, nach denen sie dafür suchen, heißen Fusionsinhibitoren. Der Therapieansatz ist zwar an sich nicht neu, Entwickler:innen begegnen aber einer großen Herausforderung: Viren, die während der Infektion einem Fusionsinhibitor ausgesetzt sind, mutieren. Sie werden gegen den Wirkstoff resistent und können damit förmlich entwischen.
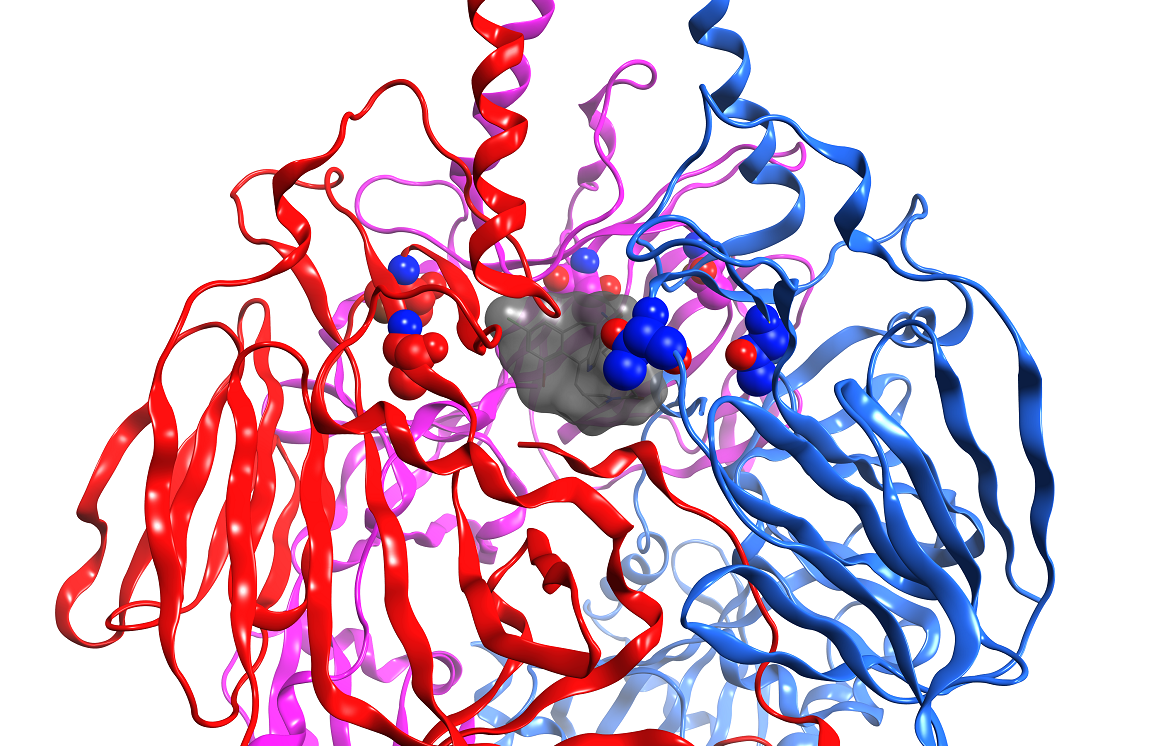
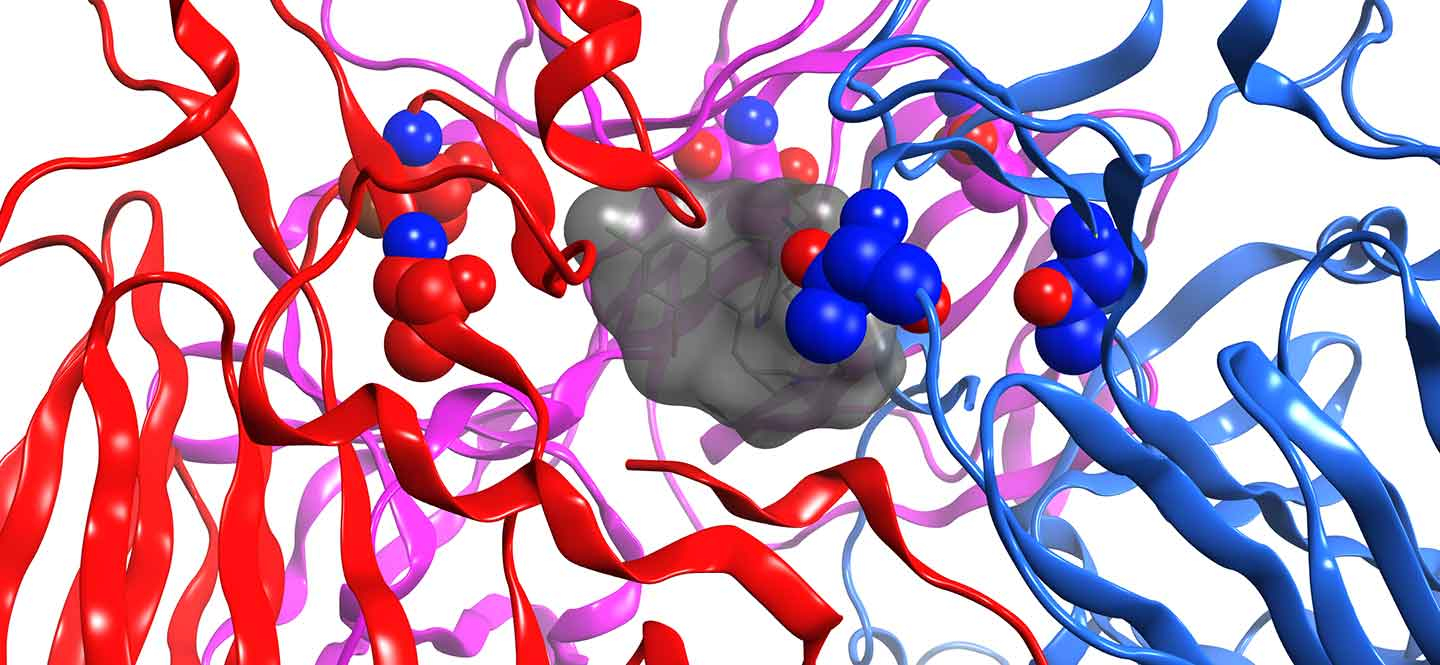
Orientierung im viralen Protein: Der Inhibitor (grau) liegt in einer Tasche des F-Proteins, das dem Virus Zutritt zur Zelle verschafft.
Resistenzen vorbeugen und überwinden
Die Forschenden kennen die Stellen, die sich dabei im F-Protein verändern, Pietschmann spricht von einem "Gürtel von Resistenzmutationen". "Wir wollen Wirkstoffe entwickeln, deren Kontaktpunkte mit dem F-Protein auch jenseits dieses Gürtels liegen", sagt er. Anfangs haben sie riesige Sammlungen von Molekülen durchsucht nach solchen, die die Fusion von RSV mit Körperzellen im Labor unterbinden. Von den vielversprechendsten Kandidaten haben sie wiederum Varianten hergestellt, um die Wirkung zu optimieren. Schließlich soll ein Wirkstoff entstehen, der auch bei Infektionen mit bereits resistenten RS-Viren einsetzbar ist und möglichst dem Aufkommen neuer Resistenzen entgegenwirkt.
Wirkstoffe gezielt verbessern
Einen entscheidenden Fortschritt für die Arbeit der Forschenden brachte das konkrete Bild von der Interaktion des Inhibitor-Moleküls mit dem F-Protein, das ein Projektpartner vor einigen Monaten aufnehmen konnte. "Bis dahin konnten wir die Inhibitor-Moleküle nur nach rationalen Überlegungen und den chemischen Möglichkeiten verändern, das war ein relativ ungerichtetes Vorgehen." Nun können sie genau sehen, wie der Inhibitor in einer Tasche des F-Proteins liegt. "Diese Orientierung zu haben und die Kontaktpunkte mit dem Inhibitor zu kennen, eröffnet ganz neue Möglichkeiten, unseren Hemmstoff zu verbessern", sagt Pietschmann. "Jetzt können wir ihn gezielt modifizieren." Damit sieht das Forschungsteam ganz neue Chancen, eine neue, verbesserte Generation von Wirkstoffkandidaten zu entwickeln.

Thomas Pietschmann ist Professor für experimentelle Virologie an der Medizinischen Hochschule Hannover und Direktor des Instituts für experimentelle Virologie am Twincore.
Interdisziplinäre Zusammenarbeit: Alles im Blick
Doch nicht nur in Hinsicht auf die Interaktion mit dem F-Protein sollen die neuen Wirkstoffe herausragend funktionieren. "Man muss bedenken", sagt Virologe Pietschmann: "Die Optimierung der Inhibitorstruktur auf das Target – also das F-Protein – verändert seine chemischen Eigenschaften." Eine Modifikation des Moleküls, die die Interaktion mit dem viralen F-Molekül verbessert, beeinflusst also möglicherweise Eigenschaften wie die Aufnahme im Körper oder seine Stabilität.
Das Konsortium hat sich deshalb interdisziplinär aufgestellt. "Mit Unterstützung von Medizinalchemiker:innen und Pharmakolog:innen haben wir diese Aspekte im Blick", schildert Pietschmann. Stets mit dabei sind Fachleute der biopharmazeutischen Firma ENYO aus Lyon. Der Konsortiumspartner hat zwei Wirkstoffkandidaten zum Projekt beigesteuert. "Unsere gemeinsame Strategie ist eine multiparametrische Optimierung des Wirkstoffs, die den besten Kompromiss zwischen all seinen erforderlichen Eigenschaften einregelt."
Vom Moleküldesign bis zur Wirkstofftestung
Am Anfang steht das Design neuer Molekülvarianten. Schon dabei sitzen alle an einem Tisch – Virolog:innen, Strukturbiolog:innen, Medizinalchemiker:innen… Oft gebe es spannende Diskussionen, erzählt Pietschmann. "Erkennen wir etwa anhand der Proteinstruktur einen neuen potenziellen Kontaktpunkt, kann es sein, dass die Chemiker uns zunächst sagen: Da kommen wir mit dem Inhibitor-Molekül so einfach nicht hin. Wenn wir es an der Stelle verändern, wird es instabil." Sie seien dann sehr engagiert, chemisch machbare Erweiterungen des Moleküls auszuklügeln.
Die Kontaktpunkte mit dem Inhibitor zu kennen, eröffnet ganz neue Möglichkeiten...
Und auch bei der Beurteilung neuer Wirkstoffkandidaten arbeiten die Projektpartner Hand in Hand. In Hannover testen die Virolog:innen, wie stark neue Moleküle die Infektion hemmen – auch mit RS-Viren, gegen die bisherige Inhibitoren nichts mehr ausrichten können. Sehen sie eine Verbesserung, überprüfen Projektpartner am Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS) verschiedene pharmakologische Eigenschaften. "Dass wir hierfür über eine Bandbreite von Testmethoden verfügen und verschiedenste Expertisen mitbringen, ist eine weitere Stärke des Projektverbunds."
Endspurt zum Zwischenergebnis
Bei so viel geteilter Arbeit gibt es viel zu besprechen, Daten zu präsentieren, Ergebnisse zu diskutieren. Und auch wenn viele Beteiligte sich nur aus Videokonferenzen kennen, verstehen alle sich sehr gut. "Die Projektmeetings machen immer auch Spaß", erzählt Pietschmann. Nicht nur, aber vielleicht besonders, wenn ungewöhnliche Perspektiven ins Spiel kommen: Die Videokachel einer Mitarbeiterin wurde während einer Konferenz verkehrt herum angezeigt. "Obwohl ihre Welt kopfstand, haben wir tolle Insights von ihr bekommen – und alle herzhaft gelacht."
Zum Abschluss der laufenden Förderung sollen im kommenden Frühjahr ausgewählte Molekülvarianten auf ihre infektionshemmende Wirkung im Tiermodell getestet werden. "Da werden wir die Ergebnisse aus dem Labor im ganzen Organismus überprüfen und schärfen", sagt Pietschmann. Für ihn sei das aber nur ein Zwischenergebnis. "Unser Ziel ist, den besten Fusionsinhibitor zu entwickeln, der bisher beschrieben ist."
