Neue Methode zur Therapie von Hirntumoren entwickelt
Gefährliche Hirntumore, die sog. Glioblastome, sind kaum zu behandeln. Lichtenberg-Professor Björn Scheffler und sein Team entwickeln maßgeschneiderte Strategien zu ihrer Eindämmung.
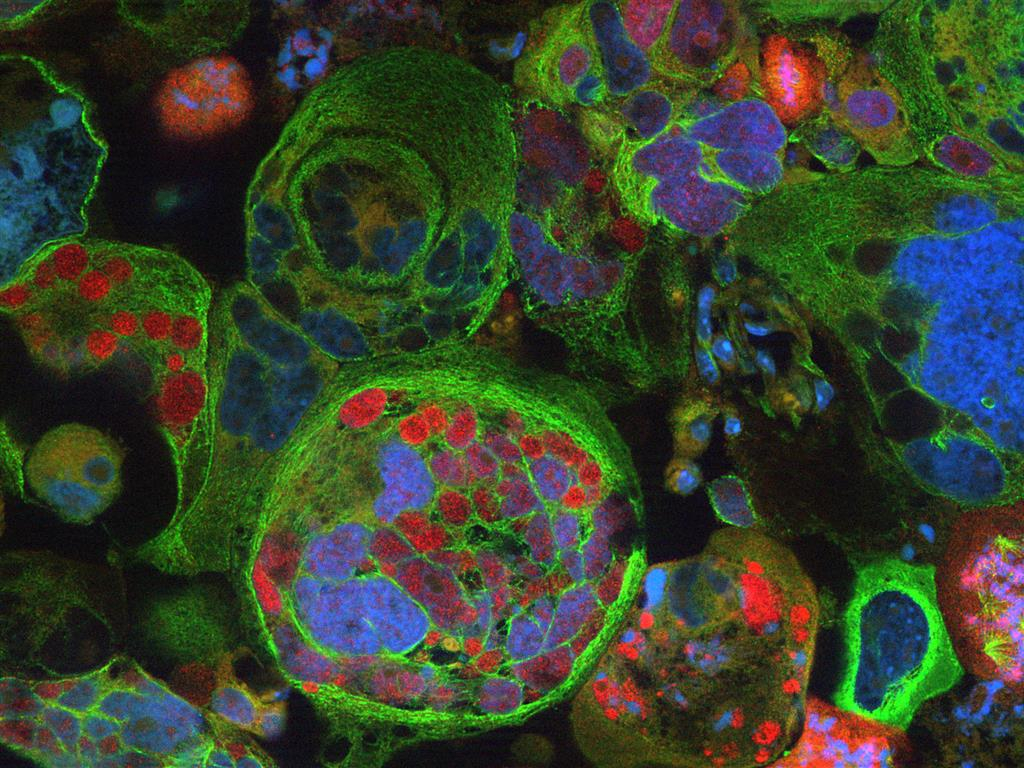
Glioblastome sind unheilbare, bösartige Hirntumore. Patienten, die unter dieser Erkrankung leiden, überleben nur wenige Monate. Die Schwierigkeit für eine Therapie der Tumore ist die Verschiedenartigkeit ihrer Zellen: Die Zellen können sehr unterschiedliche Eigenschaften beispielsweise hinsichtlich ihrer Größe oder der Zahl der Zellkerne aufweisen. Da die verschiedenen Krebszellen innerhalb eines Tumorgewebes auch unterschiedliche Abwehrmethoden gegen Therapiemaßnahmen entwickeln, gestaltet sich die chemotherapeutische Behandlung der Patienten außerordentlich schwierig. Ein Team aus Forschenden um Professor Björn Scheffler, Institut für Rekonstruktive Neurobiologie der Universität Bonn, die unter anderem am Universitätsklinikum Bonn, dem Life & Brain Zentrum, dem Deutschen Konsortium für Translationale Krebsforschung, der Tufts University Boston/Massachusetts und weiteren Instituten in den USA arbeiten, hat einen neuen Weg entwickelt, wie sich solch komplexe Hirntumore besser bekämpfen lassen. Die Ergebnisse ihrer Forschung sind nun online veröffentlicht und erscheinen demnächst in der Druckausgabe des Fachjournals "Clinical Cancer Research".
Ihr Ansatz: Eine auf jeden Patienten individuell zugeschnittene zweistufige Therapie. Die Forscher haben durch die Untersuchung von Gewebe- und Zellproben von Glioblastom-Patienten festgestellt, dass darin insgesamt 33 individuelle, vermehrungsfähige Krebszellen bestanden, die im Labor zu sehr unterschiedlichen Tumoren heranwuchsen. Diese unterschiedlichen Facetten des Tumors haben sie separat untersucht und die beste Therapie für jede einzelne ermittelt, mithilfe von rund 180 verschiedenen Wirkstoffen.
Eine überraschende Beobachtung machten sie dabei, wie Roman Reinartz, Erstautor der Studie und Teil des Teams um Professor Scheffler, berichtet: "Ein und derselbe Wirkstoff konnte dafür sorgen, dass die meisten Tumor-Facetten abstarben." Die Krebszellen einzelner anderer Tumor-Facetten des gleichen Patienten überlebten die Behandlung allerdings und konnten sich sogar viel stärker vermehren. "Diese zunächst resistenten Tumor-Facetten ließen sich mit anderen Wirkstoffen dann viel wirksamer bekämpfen." Statt wie bisher auf zeitgleiche Anwendung von kombinierten Chemotherapien zu setzen, wollen die Forscher künftig schrittweise vorgehen und im besten Falle nur noch zwei Wirkstoffe zur Therapie einsetzen.
Ordnung ins Chaos
Damit sich der Tumor im Gehirn nicht weiter verbreitet, sollen wie bisher Teile operativ entfernt werden. Die daraus gewonnen Gewebeproben sollen in Labortests untersucht werden, um zu erforschen, wie die verschiedenen Tumor-Facetten auf Behandlung ansprechen. Auch, welche Substanzen die verschiedenartigen Krebszellen zunächst vereinheitlichen, soll in diesem Schritt geklärt werden. So lässt sich für jeden Patienten die geeignete Kombinationsbehandlung entwerfen, die im ersten Schritt aus der Vielzahl unterschiedlicher Tumorzellen eine Anhäufung gleichartiger Krebszellen machen würde. Im zweiten Schritt könnte genau die Substanz herausgesucht werden, die die schärfste Waffe gegen die speziell angereicherte Tumor-Facette darstellt. "Wie bei einem Auto, das in seine Einzelteile zerlegt und auf Schäden geprüft wird, untersuchen wir die verschiedenen Krebszellen", vergleicht Björn Scheffler die Vorgehensweise. Wenn die Eigenschaften der Zellen des Tumors bekannt seien, könne mit diesem Wissen das komplexe System in die richtige Richtung gelenkt werden.
"Unsere Strategie kann die Therapiechancen künftig absehbar erheblich verbessern, weil der Weg über die Tumorproben eine sehr genaue Vorhersage für die maßgeschneiderte Behandlung der Patienten erlaubt." Bislang haben die Forscher diese Schritte im Mausmodell erfolgreich nachvollzogen. Um die Therapie auch für Menschen verfügbar zu machen, ist jedoch noch weitere Forschung erforderlich. Björn Scheffler wurde über acht Jahre seit 2008 im Rahmen der Förderinitiative "Lichtenberg-Professuren" der VolkswagenStiftung gefördert.
Informationen zur Publikation
Hintergrund der Förderinitiative "Lichtenberg-Professuren"
Neue, unkonventionelle Forschungsschwerpunkte setzen sich oft nur schwer in der traditionellen Wissenschaftslandschaft durch. Ebenso fehlt es Nachwuchswissenschaftler(inne)n häufig an längerfristigen Perspektiven, um an deutschen Hochschulen Fuß zu fassen. Damit herausragende Wissenschaftler(innen) aus innovativen Lehr- und Forschungsfeldern für die Arbeit an deutschen Hochschulen gewonnen werden können, wurden die "Lichtenberg-Professuren" ins Leben gerufen. Die Initiative ermöglicht ihnen eine größere Planungssicherheit und die Chance, neue Forschungsfelder eigenständig voranzubringen.
Fünf bis acht Jahre lang unterstützt die Stiftung herausragende Wissenschaftler(innen) dabei, frühzeitig ein eigenständiges neues und interdisziplinäres Forschungsfeld an einer Universität ihrer Wahl fest zu verankern. Der nächste Stichtag für Einreichungen ist der 1. Juni 2017.
Link zu weiteren Informationen über die Förderinitiative "Lichtenberg-Professuren".