Nanokanäle helfen Bakterien bei Nährstoffmangel
Nährstoffmangel führt nicht zwangsläufig dazu, dass Bakterien sterben. Sie helfen sich innerhalb der meist artenreichen Gemeinschaften, in denen sie leben, oft gegenseitig aus – das wissen Forscher bereits seit Längerem. Denn dadurch sparen die Mikroorganismen Ressourcen und steigern gleichzeitig Wachstum und Effizienz.
Am Max-Planck-Institut für chemische Ökologie (MPI CE) in Jena haben Wissenschaftler gemeinsam mit Kollegen der Universitäten Jena, Kaiserslautern und Heidelberg herausgefunden, wie dieser Austausch von Nährstoffen und anderen Stoffwechselprodukten praktisch vonstatten geht. Sie haben entdeckt, dass manche Bakterien Nanokanäle für den Stoffaustausch ausbilden. Ihre Erkenntnisse haben sie jetzt in dem Artikel "Metabolic cross-feeding via intercellular nanotubes among bacteria" in der Fachzeitschrift Nature Communications veröffentlicht. An dem Forschungsprojekt war die von Dr. Christian Kost geleitete Forschungsgruppe Experimentelle Ökologie und Evolution am MPI CE federführend beteiligt. Seine Arbeitsgruppe widmet sich der zentralen Frage, warum Lebewesen miteinander kooperieren. Die VolkswagenStiftung unterstützt den Wissenschaftler seit 2010 innerhalb ihrer auslaufenden Förderlinie "Evolutionsbiologie".

Gemeinsam stark
Bislang war nicht bekannt, ob Mikroorganismen Substanzen ausschließlich über die Umwelt, z. B. ein Nährmedium, austauschen oder ob sie dafür direkte Verbindungen zwischen den Zellen nutzen. Um herauszufinden, welche Wege Bakterien nutzen, hat das Wissenschaftlerteam gezielt bakterielle Gene ausgeschaltet, sodass die Mikroorganismen manche Aminosäuren nicht mehr produzieren konnten, andere wiederum in erhöhtem Maße herstellten. Für ihre Experimente nutzten sie das Bodenbakterium Acinetobacter baylyi sowie den Darmkeim Escherichia coli. Das Ergebnis: Wurden die Bakterien gemeinsam in einem Nährmedium kultiviert, zeigten sie gutes Wachstum, konnten also den experimentell erzeugten Aminosäuremangel gegenseitig auszugleichen. Wurden die Bakterien allerdings durch einen Filter voneinander getrennt, der Aminosäuren im Nährmedium zwar durchließ, einen direkten Kontakt zwischen den beiden Bakterienstämmen jedoch verhinderte, konnte keiner der beiden genetisch modifizierten Stämme wachsen. Daraus schlossen die Forscher, dass ein direkter Kontakt zwischen den Zellen notwendig ist, um Nährstoffe auszutauschen.
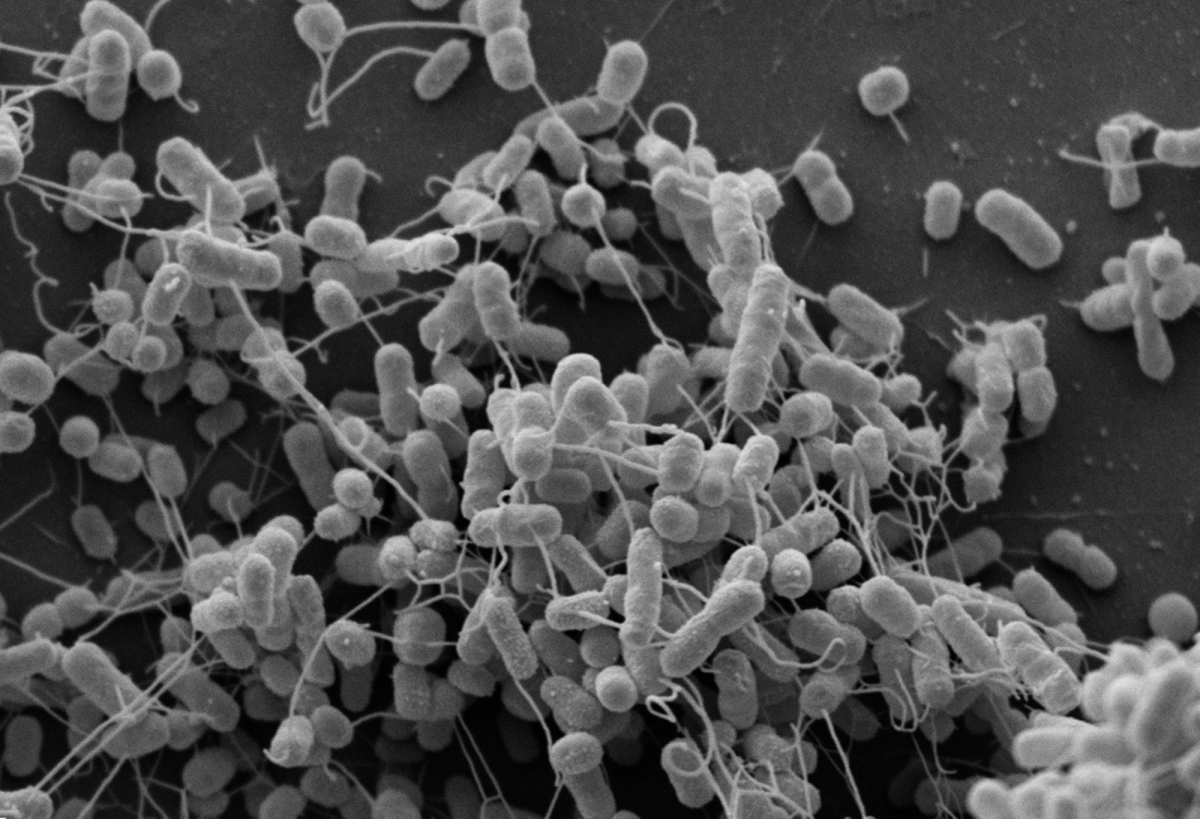
Auf welchem Weg dieser Austausch bei direktem Kontakt stattfindet, konnten die Forscher im Elektronenmikroskop beobachten: Zwischen den Bakterienzellen entstanden Nanokanäle. Allerdings bildete nur Escherichia coli, nicht aber Acinetobacter baylyi diese Strukturen aus.
"Hungrige" Zellen werden aktiv
Um ihre Ergebnisse zu verifizieren, haben die Wissenschaftler einen Gegenversuch gemacht, bei dem sie dem Nährmedium alle notwendigen Stoffe zugegeben haben – also auch die Aminosäuren, die die genetisch manipulierten Mikroorganismen nicht mehr selbstständig bilden konnten. Bei diesem Experiment entwickelten sich keine Nanokanäle. "Die Ausbildung dieser Strukturen hängt also davon ab, wie "hungrig" eine Zelle ist", erklärt Dr. Christian Kost. Ob neben der Effizienzsteigerung auch andere Gründe für den Bau der Nanostrukturen vorliegen, beispielsweise dass einzelne Bakterienarten andere Bakterien parasitisch anzapfen und aussaugen, müssen weitere Untersuchungen klären. Unklar ist zudem, ob die Bakterien gezielt steuern können, an welche Zelle sie sich anheften, um einen möglichen Schaden durch den Partner zu vermeiden. Auch weitere Fragen sind noch offen, sagt Kost: "Die spannendste Frage bleibt für mich, ob es sich bei Bakterien tatsächlich um einzellige, relativ einfach strukturierte Organismen handelt, oder ob wir es mit einer anderen Form der Vielzelligkeit zu tun haben."
